

Европейската комисия одобри лекарството против рак Tevimbra на BeiGene Ltd., което го прави първото лекарство от този вид, разработено в Китай, което става достъпно на печелившия, все по-претъпкан западен пазар.
Въпреки одобрението, BeiGene и Novartis AG съвместно прекратиха партньорството, което сключиха през 2021 г. за разработване на лекарството, второто такова прекратяване между компаниите за малко повече от два месеца.
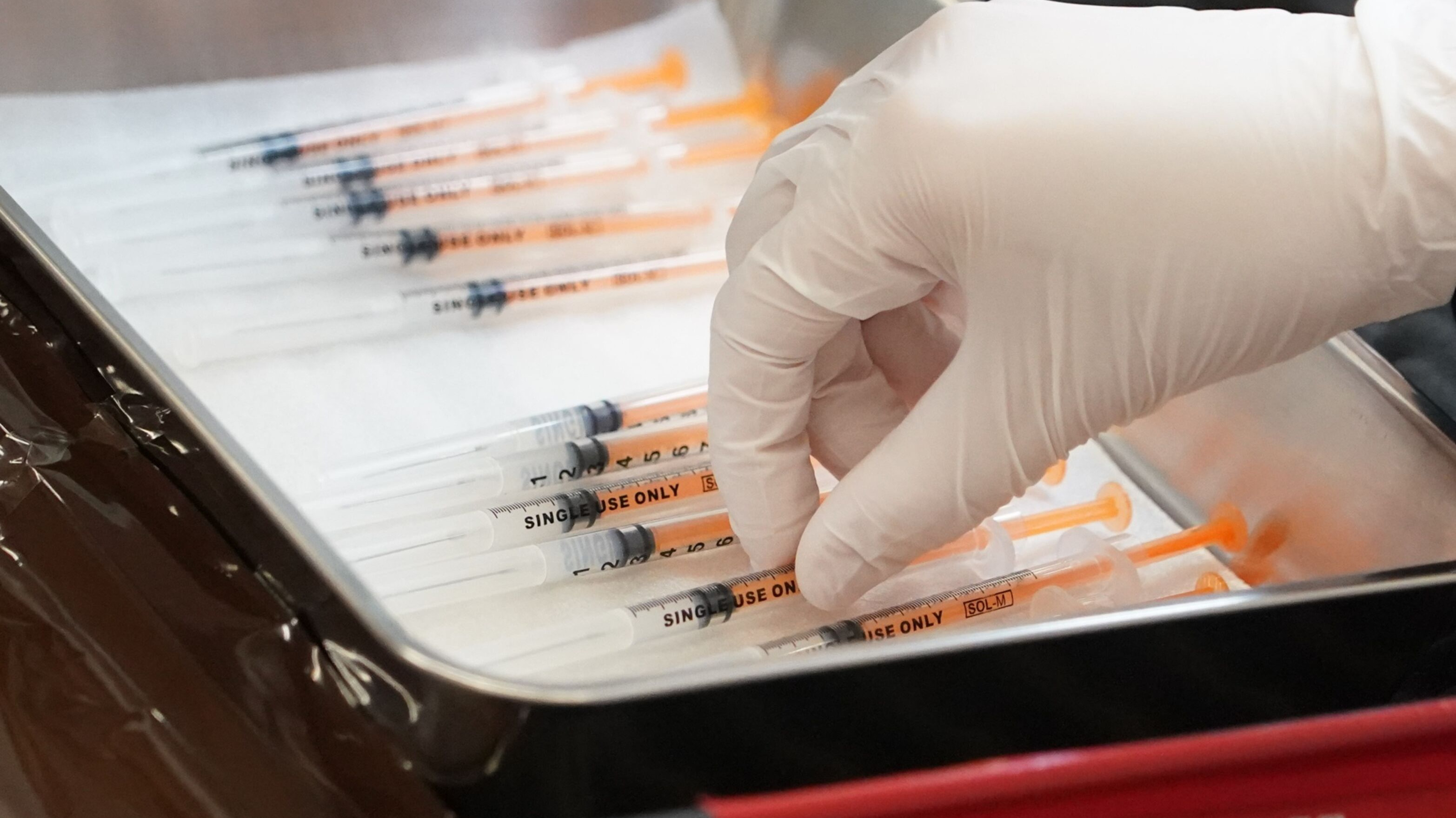
Tevimbra беше одобрен за възрастни с вид рак на хранопровода, който се влошава след първоначално лечение, каза базираният в Пекин производител на лекарства в съобщение във вторник. Tevimbra е така нареченият инхибитор PD-1, подобен на блокбъстъра Keytruda на Merck & Co., който впряга имунната система на пациента да се бори с туморите. Лекарството също така е в процес на преглед от Администрацията по храните и лекарствата на САЩ (FDA).
Въпреки че Tevimbra се използва широко в Китай, европейското одобрение бележи първото успешно нахлуване на този вид терапия в западните страни, които представляват по-голямата част от продажбите на PD-1. Анализаторите очакват пазарът, доминиран от Merck и Bristol-Myers Squibb Co., да достигне връх от 56,3 милиарда долара в световен мащаб през 2026 г.
BeiGene е сред множеството китайски биотехнологични фирми, които се появиха през последното десетилетие, когато Пекин започна основна реформа в здравеопазването, предназначена да насърчи местните фармацевтични иновации. Компанията влезе в историята през 2019 г., когато нейната терапия за рак на кръвта Brukinsa стана първото китайско лекарство за рак, одобрено в САЩ.
Успехът в получаването на одобрения в САЩ и Европа за иновативни терапии, разработени в Китай, остава неуловим за много компании. Китайските производители на лекарства са изправени пред въпроси, вариращи от състава на пациентите в техните клинични изпитвания до способността им да докажат, че лекарствата работят по-добре от сегашния стандарт на грижа.
Миналата година FDA отхвърли заявлението на Innovent Biologics Inc. за одобрение на нейната PD-1 терапия, докато друго лекарство за рак от HutchMed China Ltd. също беше отхвърлено.
Още по темата
- 1 Износът на руски петрол от Балтийско море неочаквано се срина
- 2 Талибаните отказаха на Тръмп да върнат оръжия на САЩ за милиарди
- 3 От митата до имиграцията: какви заповеди подписа Тръмп в първия си ден
- 4 Пожар в хотел в ски курорт в Турция убива 66 души - има арестувани
- 5 Най-трайното наследство на Байдън ще бъде Доналд Тръмп




 Бизнес старт – сутрешен блок с Роселина Петкова и Христо Николов
Бизнес старт – сутрешен блок с Роселина Петкова и Христо Николов




 Тръмп срещу „дълбоката държава“: Дневният ред на вендетата се оформя
Тръмп срещу „дълбоката държава“: Дневният ред на вендетата се оформя  10 трика за намаляване на стреса
10 трика за намаляване на стреса  Йемен разпространи кадри на пуснатите българи
Йемен разпространи кадри на пуснатите българи  Шест начина да облекчите болките в ставите
Шест начина да облекчите болките в ставите 
 ЦСКА смени съперника за утрешната си контрола
ЦСКА смени съперника за утрешната си контрола  Един убит и двама ранени при атака с нож в Централна Япония
Един убит и двама ранени при атака с нож в Централна Япония  Израел убиха боец на "Ислямски джихад" по време на примирието
Израел убиха боец на "Ислямски джихад" по време на примирието  Късна емисия
Късна емисия 
 20-годишен футболист се похвали с McLaren 570 GT
20-годишен футболист се похвали с McLaren 570 GT  Уникален Nissan Skyline е изложен за продан
Уникален Nissan Skyline е изложен за продан  Лампата на въздушната възглавница свети – какво да направите?
Лампата на въздушната възглавница свети – какво да направите?  Без SUV в Топ 3 на най-продаваните коли в Европа за 2024
Без SUV в Топ 3 на най-продаваните коли в Европа за 2024 
 Илия Груев влезе в игра като резерва, Лийдс бие
Илия Груев влезе в игра като резерва, Лийдс бие  Леао донесе пета поредна победа на Милан
Леао донесе пета поредна победа на Милан  Лаутаро подпечата мястото на Интер в топ 8
Лаутаро подпечата мястото на Интер в топ 8  Няма такъв мач! Рожденик закла Байерн в Ниската земя
Няма такъв мач! Рожденик закла Байерн в Ниската земя 
 продава, Парцел, 1139 m2 Стара Загора област, с.Дворище, 6000 EUR
продава, Парцел, 1139 m2 Стара Загора област, с.Дворище, 6000 EUR  продава, Тристаен апартамент, 124 m2 София, Люлин Център, 223128 EUR
продава, Тристаен апартамент, 124 m2 София, Люлин Център, 223128 EUR  продава, Тристаен апартамент, 103 m2 София, Оборище, 225700 EUR
продава, Тристаен апартамент, 103 m2 София, Оборище, 225700 EUR  продава, Двустаен апартамент, 107 m2 София, Оборище, 169000 EUR
продава, Двустаен апартамент, 107 m2 София, Оборище, 169000 EUR 








